今回は、「価電子と共有結合」についての説明です。
1.初めに
身の周りに存在するあらゆる物質は原子という粒子で構成されていて、様々な原子同士が結合して様々な性質を持つ物質になっています。
この結合方式として有名なものに共有結合というものがあります。
今回は共有結合の原理と、それを理解するために必要となる電子殻や価電子の知識についてまとめてみました。
2.電子殻とは?最外殻電子とは?
電子殻[electron shell]とは、原子核の周りにある電子が存在できる層のことです。
原子は以下のような構造をしています。
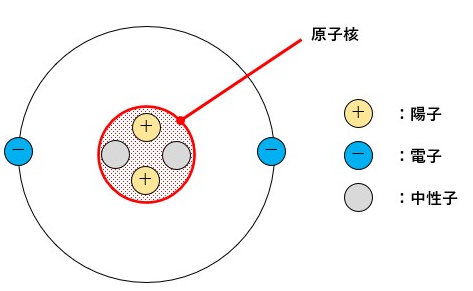
原子核の周りを負の電気を帯びた電子が回っているのです。
この電子が描いている円状の軌道が電子殻です。
電子殻の軌道上はほぼ等しいエネルギーを持っていて、電子殻は何層も存在します。
電子殻は原子核に近いほどエネルギーは低くなり、エネルギーの低い順にK殻・L殻・M殻・N殻・O殻・P殻のように呼ばれています。
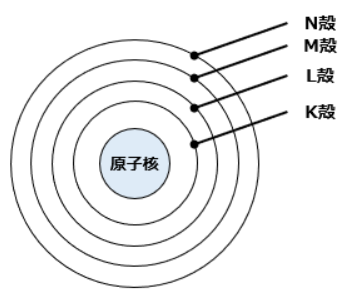
Kから始まる理由は、発見当初は更に内側の電子殻があるのではないかと考えられたため、そのマージンを設定したからだと言われています。
まあ、無かったんですけどね。
電子殻ごとに存在できる電子数には差があり、n番目の第n殻には2n2個の電子が入ることが可能です。
要するに、第1殻であるK殻は2個、第2殻であるL殻は8個、第3殻であるM殻は16個、第4殻であるN殻は32個の電子が入れるわけです。
n2のような累乗に明るくない方は、以下の記事も参考にしてみてください。
電子は基本的にエネルギーの低い電子殻から順番に入っていくので、K殻が埋まったらL殻へ、L殻が埋まったらM殻へ…という具合に位置していきます。
この時に最も外側にある電子殻に存在する電子のことを最外殻電子と呼びます。
例えば、電子が11個あったとしたら、K殻に2個、L殻に8個、残りの1個がM殻に入るので、最外殻電子は1個ということになります。
電子が存在する一番外側の電子殻が電子で埋まっているほど安定した状態になります。
3.価電子とは?
価電子[valence electron]とは、共有結合に使用できる余剰の最外殻電子のことです。
ほとんどの場合、最外殻電子=価電子になります。
“ほとんど”ね。
例えば、電子が10個あったとしたら、L殻は全部埋まって8個の最外殻電子を持つことになります。
なのですが、電子が存在する一番外側の電子殻が電子で全部埋まっていると、その状態は“極めて安定した状態”になります。
要するに、電子の受け渡しをしたりという変化を求めていないんです。
もう完成されているから周りに干渉したくないんですよ。
このような状態の原子のことを希ガスと呼びます。
周期表で言うところの18族の元素が希ガスです。
ヘリウム・ネオン・アルゴンなどです。
その為、希ガスの価電子は0個になります。
自由に動ける電子が価電子というイメージを持つと良いかもしれませんね。
4.共有結合とは?
共有結合[covalent bond]とは、原子間で価電子を共有することで原子が結合する現象のことです。
先程述べたように、18族の希ガスのように最外殻電子が全て埋まった状態が原子にとって最も安定した状態となります。
希ガス以外は、電子がちょっと足りなかったり余分だったりして、ちょっとアンバランスなんです。
例えば、図3は14族のシリコン(Si)原子と18族のアルゴン(Ar)原子の価電子・最外殻電子の状態を表しています。
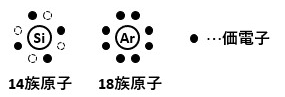
理想は、希ガスであるアルゴン原子のように最外殻電子が全部埋まって価電子の無い状態になっていることです。
なのですが、14族のシリコン原子は最外殻に4箇所空きがあるんですね。
そこで、複数のシリコン原子が互いに電子を共有することで、各々の最外殻電子を8個にしようとするわけです。
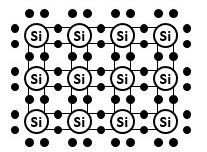
つまり、価電子をお互いに共有して、結合するのです。
だから“共有結合”と呼ぶわけです。
「足りない or 余分な電子を周りの原子と補い合った結果くっついている」、これだけなんですね。
以上、「価電子と共有結合」についての説明でした。





